EQUAÇÃO DE GRACELI.. PARA INTERAÇÕES DE ONDAS E INTERAÇÕES DAS FORÇAS FUNDAMENTAIS.
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
1 / G* = = [ ] ω , , / T] / c [ [x,t] ] [-1] =
G* = = OPERADOR DE GRACELI = Em mecânica quântica, o OPERADOR DE GRACELI [ G* =] é um operador cujo observável corresponde à ENERGIA TOTAL DO SISTEMA , TODAS AS INTERAÇÕES INCLUINDO TODAS AS INTERAÇÕES DAS FORÇAS FUNDAMENTAIS [AS QUATRO FORÇAS] [ELETROMAGNÉTICA, FORTE, FRACA E GRAVITACIONAL], INTERAÇÕES SPINS-ÓRBITAS, ESTRUTURRA ELETRÔNICA DOS ELEMENTOS QUÍMICOS, TRANSFORMAÇÕES, SISTEMAS DE ONDAS QUÂNTICAS, MOMENTUM MAGNÉTICO de cada elemento químico e partícula, NÍVEIS DE ENERGIA , número quântico , e o sistema GENERALIZADO GRACELI.
COMO TAMBÉM ESTÁ RELACIONADO A TODO SISTEMA CATEGORIAL GRACELI, TENSORIAL GRACELI DIMENSIONAL DE GRACELI..
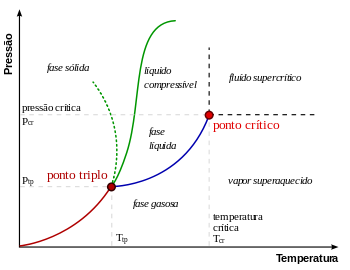
Em física, termodinâmica, química, físico-química e física da matéria condensada, um ponto crítico, também chamado de estado crítico, ocorre sob condições (tais como valores específicos de temperatura, pressão ou composição) no qual não existem limites de fase. Existem vários tipos de pontos críticos, incluindo pontos críticos líquido-vapor e líquido-líquido.[1][2]
Substâncias puras: ponto crítico líquido-vapor
O "ponto crítico" é por vezes usado para denotar o ponto especificamente vapor-líquido crítico de um material, a partir do qual a distinção entre fase a líquida e gasosa não existe.
O ponto crítico de vapor-líquido em um diagrama de fases pressão-temperatura está no extremo de alta temperatura do limite de fase líquido-gás. A linha pontilhada verde mostra o comportamento anômalo da água.[3]
Como se mostra no diagrama de fases para a direita, isto é o ponto em que a fronteira entre a fase líquida e gasosa termina. Em água, o ponto crítico ocorre em cerca de 647 K. (374 ° C; 705 ° F) e 22,064 MPa (218 atm)
À medida que a substância se aproxima da temperatura crítica, as propriedades da sua fases gasosa e líquida convergem, resultando em apenas uma fase no ponto crítico: um fluido supercrítico homogêneo. O calor de vaporização é zero no ponto crítico e para além dele, por isso não existe distinção entre as duas fases. No diagrama de Pressão-temperatura, o ponto em que a temperatura crítica e pressão crítica satisfazer é chamado de ponto crítico da substância. Acima da temperatura crítica, um líquido não pode ser formada por um aumento da pressão, apesar de um sólido poder ser formado sob uma pressão suficiente. A pressão crítica é a pressão de vapor, à temperatura crítica. O volume crítico é o volume molar de uma mole do material a uma temperatura e pressão críticas.
Propriedades críticas variam de material para material, e para muitas substâncias puras estão prontamente disponíveis na literatura. No entanto, a obtenção de propriedades críticas para misturas é mais desafiador.
Definição matemática
No caso das substâncias puras, há um ponto de inflexão na curva isotérmica crítica (linha de temperatura constante) com um diagrama de Pressão-Volume. Isto significa que, no ponto crítico: [4][5][6]
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Isto é, as primeira e segunda derivadas parciais da pressão p no que diz respeito ao volume V são ambos zero, com as derivadas parciais avaliados em temperatura constante T. Esta relação pode ser usada para avaliar dois parâmetros de uma equação de estado em termos das propriedades críticas, tais como os parâmetros a e b na equação de van der Waals.[4]
Às vezes um conjunto de propriedades reduzidas é definida em termos das propriedades importantes, isto é:[7]
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde é a temperatura reduzida, é a pressão reduzida, é a redução do volume, e é a constante universal dos gases.
Fluido supercrítico é qualquer substância em uma temperatura e pressão acima do seu ponto crítico, no qual não existe mais distinção entre as fases líquida e gasosa. Ele sofre efusão através de sólidos como um gás, e pode dissolver materiais como um líquido. Além disso, perto do seu ponto crítico, pequenas mudanças em sua pressão ou temperatura resultam em grandes mudanças de densidade, permitindo que sejam feitos pequenos ajustes nas propriedades de um fluido supercrítico.
Os fluidos supercríticos são substitutos adequados a solventes orgânicos em uma variedade de processos industriais e laboratoriais. Dióxido de Carbono e água são os fluidos supercríticos mais comumente usados, para descafeinação e geração de eletricidade, respectivamente.
Propriedades
Em termos gerais, fluidos supercríticos tem propriedades entre a de um gás e a de um líquido. Na Tabela 1, as propriedades críticas de alguns componentes que são comumente usados como fluidos supercríticos são mostradas.
| Solvente | Peso molecular | Temperatura Crítica | Pressão Crítica | Densidade Crítica |
|---|---|---|---|---|
| g/mol | K | MPa (atm) | g/cm3 | |
| Dióxido de Carbono (CO2) | 44.01 | 304.1 | 7.38 (72.8) | 0.469 |
| Água (H2O) | 18.015 | 647.096 | 22.064 (217.755) | 0.322 |
| Metano (CH4) | 16.04 | 190.4 | 4.60 (45.4) | 0.162 |
| Etano (C2H6) | 30.07 | 305.3 | 4.87 (48.1) | 0.203 |
| Propano (C3H8) | 44.09 | 369.8 | 4.25 (41.9) | 0.217 |
| Etileno (C2H4) | 28.05 | 282.4 | 5.04 (49.7) | 0.215 |
| Propileno (C3H6) | 42.08 | 364.9 | 4.60 (45.4) | 0.232 |
| Metanol (CH3OH) | 32.04 | 512.6 | 8.09 (79.8) | 0.272 |
| Etanol (C2H5OH) | 46.07 | 513.9 | 6.14 (60.6) | 0.276 |
| Acetona (C3H6O) | 58.08 | 508.1 | 4.70 (46.4) | 0.278 |
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
A Tabela 2 mostra densidade, coeficiente de difusão e viscosidade para gases, líquidos e fluidos supercríticos típicos.
| Densidade (kg/m3) | Viscosidade (µPa∙s) | Coeficiente de difusão (mm²/s) | |
|---|---|---|---|
| Gases | 1 | 10 | 1–10 |
| Fluidos supercríticos | 100–1000 | 50–100 | 0.01–0.1 |
| Líquidos | 1000 | 500–1000 | 0.001 |
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Além disso, não há tensão superficial em um fluido supercrítico, já que não há uma divisão entre as fases líquida e gasosa. Mudando a pressão e temperatura do fluido, as propriedades podem ser ajustadas para serem mais parecidas com as de um líquido ou de um gás. Uma das mais importantes propriedades é a solubilidade do material no fluido. Solubilidade num fluido supercrítico tende a aumentar com a densidade do fluido (a uma temperatura constante). Já que a densidade aumenta com a pressão, a solubilidade tende a aumentar com a pressão. A relação com a temperatura é mais complicada. À uma densidade constante, a solubilidade irá aumentar com a temperatura, no entanto, perto do ponto crítico, a densidade pode cair abruptamente com um pequeno aumento de temperatura. Portanto, perto da temperatura crítica, a solubilidade geralmente cai com um aumento de temperatura e então cresce de novo.[2]
Todos os fluidos supercríticos são completamente miscíveis uns com os outros, então para uma mistura uma única fase pode ser garantida se o seu ponto crítico for excedido. O ponto crítico de uma mistura de dois elementos pode ser estimada através da média aritmética das temperaturas e pressões críticas dos dois componentes.[3]
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde:
- e são as frações molares dos componente A e B e,
- e : são suas respectivas Temperaturas Críticas.
Para uma maior precisão, o ponto crítico pode ser calculado usando equações de estado, como as de Peng Robinson, ou métodos de contribuição de grupo. Outras propriedades, como a densidade, podem ser calculadas usando equações de estado.
O ponto de Draper é a temperatura aproximada acima da qual quase todos os materiais sólidos brilham visivelmente como resultado da radiação de corpo negro.[1][2][3] Foi estabelecido em 525° C (798 K) por John William Draper em 1847.[4]
Corpos a temperaturas logo abaixo do ponto Draper irradiam principalmente na faixa infravermelha e emitem luz visível insignificante. O valor do ponto de Draper pode ser calculado usando a lei de deslocamento de Wien: a freqüência (em hertz) emitida por um corpo negro se relaciona com a temperatura da seguinte forma[5]
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
onde
- k é Constante de Boltzmann,
- h é Constante de Planck,
- T é temperatura (em kelvins).
Substituir o ponto de Draper nesta equação produz uma freqüência de 83 THz, ou um comprimento de onda de 3,6 µm, que é bem dentro do infravermelho e completamente invisível ao olho humano. No entanto, a borda principal da curva de radiação do corpo negro se estende, em uma pequena fração do pico da intensidade, para o infravermelho próximo e vermelho-escuro (aproximadamente o intervalo 0,7-1 m), que são muito fracamente visíveis como um vermelho opaco.
De acordo com a lei de Stefan-Boltzmann, um corpo negro no ponto Draper emite 23 quilowatts de radiação por metro quadrado, quase exclusivamente infravermelho.
Cor observada pelo olho humano emitida por um corpo negro
| °C (K) | Cor[6] |
|---|---|
| 480 °C (753,15 K) | brilho avermelhado fraco |
| 580 °C (853,15 K) | vermelho escuro |
| 730 °C (1003,15 K) | vermelho brilhante, levemente alaranjado |
| 930 °C (1203,15 K) | laranja brilhante |
| 1100 °C (1373,15 K) | laranja amarelado pálido |
| 1300 °C (1573,15 K) | amarelo claro |
| > 1400 °C (1673,15 K) | branco (amarelado se visto a distâncias superiores à da atmosfera) |
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Ponto de fulgor, ou ponto de Inflamação, é a menor temperatura na qual um combustível liberta vapor em quantidade suficiente para formar uma mistura inflamável por uma fonte externa de calor. O ponto de fulgor, ou de inflamação, não é suficiente para que a combustão seja mantida.
Por mistura inflamável, para a obtenção do ponto de fulgor, entenda-se a quantidade de gás ou vapor misturada com o ar atmosférico suficiente para iniciar uma inflamação em contacto com uma fonte de calor (isto é, a queima abrupta do gás ou vapor), sem que haja a combustão do combustível emitente. Outro detalhe verificado é que, ao retirar-se a fonte de calor, acaba a inflamação (queima) da mistura.
Trata-se de um dado importante para classificação dos produtos combustíveis, em especial no que se refere à segurança, aos riscos de , armazenagem e manuseamento.
O ponto de fulgor não deve ser confundido com a temperatura de autoignição, a qual não requer uma fonte de ignição, ou o ponto de combustão, a temperatura na qual o vapor continua a queimar após ter sofrido ignição. Nem o ponto de fulgor, nem o ponto de combustão são dependentes da temperatura da fonte de ignição, que é muito mais elevada.
O ponto de fulgor é frequentemente usado como uma característica descritiva de líquidos combustíveis e é também usado para ajudar a caracterizar os perigos de inflamação de líquidos. O conceito de ponto de fulgor refere-se tanto a líquidos inflamáveis quanto a combustíveis. Existem vários padrões para se definir cada termo. Líquidos com um ponto de fulgor menor do que 60,5 °C ou 37,8 °C, dependendo do padrão sendo aplicado, são considerados inflamáveis, enquanto líquidos com pontos de fulgor acima de certas temperaturas são considerados combustíveis.[1]
Exemplos
| Combustível | Ponto de fulgor | Auto-ignição | Ponto de congelamento |
|---|---|---|---|
| Etanol (70%) | 16,6 °C (61,88 °F)[2] | 363 °C (685,40 °F)[2] | -117 °C [3] |
| Gasolina | -42,8 °C (-45 °F) | 246 °C (495 °F) | -100 °C [4] |
| Diesel | >38 °C (101 °F) | 210 °C (410 °F) | 6 °C [5] |
| Querosene de aviação | >60 °C (140 °F) | 210 °C (410 °F) | -47 °C [6] |
| Querosene (óleo de parafina) | >38° a 72 °C (100° a 162 °F) | 220 °C (428 °F) | -20 °C [7] |
| Óleo vegetal (canola) | 327 °C (620 °F) | ||
| Biodiesel | >130 °C (266 °F) |
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
Através do ponto de fulgor distinguem-se os líquidos combustíveis e inflamáveis, de acordo com norma regulamentadora:
- Líquido combustível: todo aquele que possua ponto de fulgor superior a 60°C (sessenta graus Celsius) e inferior a 93 °C.
O líquido combustível acima classifica-se como líquido combustível Classe III.
- Líquido inflamável: todo aquele que possua ponto de fulgor igual ou inferior a 60 °C (conforme NR 16).
Quando o líquido inflamável definido acima possui ponto de fulgor superior a 37,7 °C e inferior a 70 °C, ele é classificado como líquido combustível Classe II.
Em termodinâmica, o ponto triplo é um estado particular de uma substância determinado por valores de temperatura e pressão, no qual as três fases ou estados físicos da substância (sólido, líquido e gasoso) coexistem em equilíbrio.[1]
O ponto triplo do dióxido de carbono (CO2), por exemplo, ocorre na temperatura de 216,55 K e à pressão de 517 kPa. Já o ponto triplo do mercúrio ocorre à temperatura de −38,83440 °C e à pressão de 0,2 mPa.
Além do ponto triplo entre sólido, líquido e gasoso, podem existir pontos triplos envolvendo mais de uma fase sólida, nas substâncias com polimorfismo. Em geral, para um sistema com p fases possíveis, existem pontos triplos.[1]
Note que a pressão aqui referida é a pressão de vapor da substância — não a pressão total do sistema.
O ponto triplo da água é dado por definição - não por uma medição exata. É usado para definir o kelvin, a unidade de temperatura termodinâmica no Sistema Internacional de Unidades.[2][3] Os pontos triplos de várias substâncias são usados para definir pontos na Escala Internacional de Temperaturas de 1990 (ITS-90), que vai desde o ponto triplo do hidrogênio (13,8033 K) até o ponto triplo da água (273,16 K, 0,01 °C ou 32,018 °F)
Pontos triplos da água
Ponto triplo sólido-líquido-gás
A única combinação de pressão e temperatura na qual os três estados físicos da água (sólido (gelo), gasoso (vapor) e líquido) podem coexistir em equilíbrio estável ocorre exatamente quando a temperatura é de 273,16 kelvins (0,01 °C) e a pressão é de 611,73 pascals (cerca de 0,006 bar; 0,0060373 atm). Nesse ponto, é possível mudar toda a substância para gelo, água ou vapor fazendo pequenas mudanças na temperatura e pressão.
O ponto triplo sólido-líquido-gás corresponde à mínima pressão na qual a água líquida pode existir. Sob pressões abaixo do ponto triplo (como no espaço sideral), o gelo, quando aquecido a uma pressão constante, converte-se diretamente em vapor de água, num processo conhecido como sublimação. Acima do ponto triplo, o gelo, quando aquecido a uma pressão constante, primeiro derrete, formando água líquida, e depois evapora ou ferve, passando ao estado gasoso (vapor).
Para a maioria das substâncias, o ponto triplo também é a mínima temperatura na qual o líquido pode existir. Para a água, porém, isto não é verdade, por causa de seu comportamento anômalo[4] que faz com que o ponto de fusão do gelo diminua com o aumento da pressão, conforme mostra a linha verde pontilhada, no diagrama de fases (ver figura). A uma temperatura um pouco abaixo do ponto triplo (entre 251–273 K), a compressão a temperatura constante transforma o vapor de água, primeiro, em gelo I e depois em água líquida (o gelo tem uma densidade menor do que a água líquida, de modo que um aumento de pressão leva à liquefação).
Durante a missão Mariner 9, da NASA, para Marte, a pressão do ponto triplo da água foi usada como ponto de referência para o "nível do mar". Missões mais recentes utilizam altimetria a laser e medições da gravidade, em vez da pressão, para definir elevações em Marte.[5]
Outros pontos triplos da água em pressões mais altas
Em altas temperaturas, a água tem um diagrama de fases complexo com quinze fases conhecidas do gelo e um número de pontos triplos, incluíndo os dez cujas coordenadas são mostradas no diagrama. Por exemplo, o ponto triplo em 251 K (-22 °C) e 210 MPa (2070 atm) corresponde às condições de coexistência do gelo Ih (gelo comum), gelo III e água líquida, todos em equilíbrio. Mas podem existir também pontos em que três fases sólidas coexistam em equilíbrio, como a 218 K e 620 MPa.
Células do ponto triplo
Células do ponto triplo são usadas na calibração de termômetros. Para medições exatas, células de ponto triplo são geralmente preenchidas com uma substância química com alta pureza, como o hidrogênio, argônio, mercúrio ou água, dependendo da temperatura desejada. A pureza destas substâncias pode ser tal que apenas uma parte em um milhão seja um contaminante, o que significa 99,9999% puro. As células de ponto triplo são tão eficientes no alcance de temperaturas precisas e reproduzíveis que um padrão internacional de calibração de termômetros chamado ITS-90 se baseia em células de hidrogênio, neon, oxigênio, argônio, mercúrio e água para determinar seus seis pontos definidos de temperatura.
Tabela de pontos triplos
Esta tabela lista o ponto triplo sólido-líquido-gasoso de substâncias comuns. A menos que diferentemente indicadas, as informações vieram da U.S. National Bureau of Standars (agora NIST (National Institute of Standards and Technology).[6]
| Substância | T [K] | p [kPa]* |
|---|---|---|
| Acetileno | 192,4 | 120 |
| Amoníaco | 195,40 | 6,076 |
| Argônio | 83,81 | 68,9 |
| Arsênio | 1090 | 3628 |
| Butano | 134,6 | 7 × 10−4 |
| Carbono (grafite) | 4765 | 10132 |
| Dióxido de carbono | 216,55 | 517 |
| Monóxido de carbono | 68,10 | 15,37 |
| Clorofórmio | 175,43 | 0,870 |
| Deuterio | 18,63 | 17,1 |
| Etano | 89,89 | 8 × 10−4 |
| Etanol | 150 | 4,3 × 10−7 |
| Etileno | 104,0 | 0,12 |
| Ácido fórmico | 281,40 | 2,2 |
| Hélio-4 (ponto lambda) | 2,19 | 5,1 |
| Hexafluoroetano | 173,08 | 26,60 |
| Hidrogênio | 13,84 | 7,04 |
| Cloreto de Hidrogênio | 158,96 | 13,9 |
| Iodo[7] | 386,65 | 12,07 |
| Isobutano[8] | 113,55 | 1,9481 × 10−5 |
| Mercúrio | 234,2 | 1,65 × 10−7 |
| Metano | 90,68 | 11,7 |
| Neon | 24,57 | 43,2 |
| Óxido nítrico | 109,50 | 21,92 |
| Nitrogênio | 63,18 | 12,6 |
| Óxido nitroso | 182,34 | 87,85 |
| Oxigênio | 54,36 | 0,152 |
| Paládio | 1825 | 3,5 × 10−3 |
| Platina | 2045 | 2,0 × 10−4 |
| Dióxido de enxofre | 197,69 | 1,67 |
| Titânio | 1941 | 5,3 × 10−3 |
| Hexafluoreto de urânio | 337,17 | 151,7 |
| Água | 273,16 | 0,6117 |
| Xenônio | 161,3 | 81,5 |
| Zinco | 692,65 | 0,065 |
/
G* = = [ ] ω , , / T] / c [ [x,t] ] =
* Nota: Para fins de comparação, a pressão atmosférica típica é 101,325 kPa (1 atm).

 =
=



























Comentários
Postar um comentário